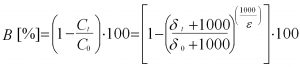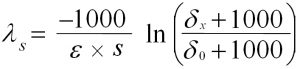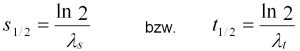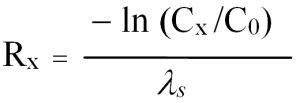Grundlagen
Stabile Isotope sind leichte und schwere Atome desselben Elements.



In der Natur kommen Isotope in einem außerordentlich konstanten Verhältnis vor, welches für jedes Element typisch ist. Der prozentuale Anteil der schweren Isotope ist in chemischen Molekülen (z. B. H2O oder Schadstoffe) ebenso wie in den Elementen meist sehr gering (z. B. 13C = 1,11%; Deuterium D=3H= 0,015%). Verschiedene chemische, physikalische und biologische Prozesse können allerdings zu einer minimalen (jedoch gut messbaren) Verschiebung des Verhältnisses schwerer und leichter Isotope (der Isotopensignatur) in einer Substanz führen, d. h. es erfolgt eine Isotopenfraktionierung.



Die Angabe der Isotopensignatur in delta ‰ beschreibt den Unterschied (Quotient) zwischen den Isotopenverhältnissen einer Probe und eines weltweiten Referenzstandards (oben). Andere Skalen (unten) sind das einfache (13C/12C) oder das prozentuale (atom%) Isotopenverhältnis.
Isotopenwerte: Einheiten und Messprinzip
Stabile Isotopen werden als Verhältnis zwischen einem schweren und einem leichten Isotop (z.B. 13C/12C) gemessen und in der sog. Deltanotation (δ‰) angegeben (siehe Abb. links). Bei der Analyse wird immer ein Referenzstandard mitgemessen und so eine hohe Messgenauigkeit und -empfindlichkeit erreicht.
Die Referenzsubstanz für 13C/12C ist der sog. Vienna PeeDee Belemnit (VPDB), ein Kalkgestein aus Nordamerika. Er besitzt per definitionem eine Isotopensignatur von 0 ‰. Sein prozentualer 13C-Isotopenanteil beträgt 1,11% und damit sein 13C/12C-Isotopenverhältnis (Rstd) von 0,01122. Ein δ-Promille entspricht etwa einem prozentualen Isotopenanteil von 0,001% (10 ppm). Eine Isotopensignatur von -1 δ‰ bedeutet somit, dass das 13C/12C-Verhältnis der gemessenen Probe um 0,000011 geringer ist als der Referenzstandard VPDB. Die meisten Schadstoffe haben einen δ13C-Wert zwischen -30‰ und -20‰.
Die Messgenauigkeit zur Bestimmung stabiler Isotopen ist außerordentlich hoch.
Bei der komponentenspezifische Isotopenbestimmung (CSIA) wird aus einem Gemisch das Isotopenverhältnis einzelner Schadstoffe ermittelt. Zuerst werden die Komponenten gaschromatografisch aufgetrennt, danach erfolgt die Verbrennung zu einfachen Molekülen (z.B. CO2) sowie Ionisierung und die Separation der schweren und leichten Isotopen im Hochvakuum-Magnetfeld. Entsprechend dieser Messprinzipien heißen die eingesetzten Geräte GC-C-IRMS (gas chromatographic combustion isotope ratio mass spectrometer) oder HPLC-C-IRMS (high performance liquid chromatograhy).
Der standardisierte Messfehler bei der Bestimmung von 13C ist <0.5‰, d. h. eine Isotopenanreicherung von mehr als 0,0005% im verbleibenden Schadstoff ist eine signifikante Veränderung. Da Wasserstoff schlechter ionisierbar ist, beträgt die Messgenauigkeit für den Deuteriumanteil von Molekülen lediglich 2-5‰. Diese Ungenauigkeit wird jedoch häufig durch eine wesentlich stärkere Isotopenfraktionierung beim biologischen Schadstoffabbau ausgeglichen.
Die Empfindlichkeit der konventionellen IRMS-Geräte für die Bestimmung des 13C-Gehalts einer Substanz beträgt etwa 1 nmol C (Meßvolumen 1 µL). Für niedrigmolekulare Schadstoffe wie BTEX oder PCE ergibt sich dadurch eine Nachweisgrenze von etwa 100 µg ml-1. Stark kontaminierte Grundwasserproben können deshalb unmittelbar untersucht werden, während bei geringeren Schadstoffkonzentrationen Extraktionsverfahren zur Anwendung kommen. Je nach Schadstoff werden hier Festphasensorption/-desorption, hydrophobe Elution oder Gasausblasung („purge and trap“-Verfahren) eingesetzt. Lediglich Letzteres führt zu einer artifiziellen Isotopenanreicherung, die korrigiert werden muss. Mit diesen Verfahren kann auch die Sensitivität zur Messung der Isotopenfraktionierung größerer Moleküle erhöht werden.
Isotopenfraktionierung: biologischer Schadstoffabbau führt bei den meisten Schadstoffen zu einer schwereren/positiveren Isotopensignatur
Das Vorkommen von schweren Isotopen in einem Molekül (z. B. 13C in einem Schadstoff) hat zur Folge, dass sich dessen Zusammenhalt minimal erhöht. Dadurch wird die enzymatische Spaltung der Moleküle mit schweren Isotopen etwas erschwert und sie reichern sich beim Abbau im verbleibenden Schadstoff an. Der prozentuale Anteil von 13C im Schadstoff kann z. B. von 1.09% auf 1.10% anwachsen, ausgedrückt in δ‰-Werten steigt er von -19.3‰ auf -10.2‰. Je nach Enzymsystem ist diese sog. Isotopenfraktionierung mehr oder weniger stark. Jedes Enzym, das einen Schadstoff spalten kann, führt zu einem spezifischen, konstanten Anreicherungsfaktor (ε), der unabhängig von der Temperatur und den Wachstumsbedingungen der Mikroorganismen ist.
Vor allem der sterische Ort des schweren Isotops innerhalb eines Moleküls disponiert die enzymatische Spaltung. Nur wenn das Isotop an der reaktiven Stelle des vom Enzym angegriffenen Moleküls liegt, kann eine signifikante Isotopenfraktionierung stattfinden. Die Wahrscheinlichkeit, dass beispielsweise ein 13C-Atom die reaktive Stelle in einem Schadstoff besetzt, verringert sich mit der Zahl aller C-Atome im Molekül. Je kleiner das abzubauende Schadstoffmolekül ist, desto größer ist der Fraktionierungseffekt. Für große Moleküle (>12 C-Atome) liegt die biologische Isotopenfraktionierung deshalb in der Regel unter der Nachweisgrenze.
Bei der Synthese einer Substanz (z. B. eines Schadstoffs) ist der Einbau von schweren Isotopen in die Moleküle abhängig von bestimmten kinetischen Bedingungen. Dies kann zu einer marginalen, noch messbaren Verschiebung des prozentualen Isotopenanteils in dieser Substanz führen. Unterschiedliche, z. B. geographisch oder technisch bedingte Synthesebedingungen erzeugen deshalb verschiedene Isotopensignaturen derselben Substanz. Auf dieser Basis können in einer Altlast unterschiedliche Kontaminationsherde ermittelt werden.
Ebenso können physikalische Prozesse wie Verdunstung (z. B. bei deuteriertem Wasser) oder Desorption Veränderungen im Isotopengehalt der beteiligten Substanzmengen bewirken.
Gl. 1: Rayleigh-Gleichung
Gl. 2: Berechnung des prozentualen Abbaus
Gl. 3: Berechnung der räumlichen Abbauratenkonstante
Gl. 4: Berechnung der zeitlichen Abbauratenkonstante
Gl. 5: Berechnung von Halbwertsstrecke und -zeit
Gl. 6: Prognose der Reaktionsstrecke Rx bis zum Unterschreiten eines Konzentrationsgrenzwerts Cx.
Gleichungen für die quantitative Berechnung des Schadstoffabbaus aus der Isotopenanreicherung
Mit Hilfe der Veränderung der Isotopensignatur eines Schadstoffes kann dessen mikrobieller Abbau berechnet werden. Dabei wird für die Abschätzung der mikrobiellen Schadstoffreduzierung die Rayleigh-Gleichung (Gl. 1; Gleichungen auch in US EPA 2008) verwendet.
dt und d0 bezeichnen das Isotopenverhältnis einer Verbindung zu einer bestimmten Zeit (t) und zu Beginn der mikrobiellen Umsetzung (t = 0). Ct und C0 geben die Konzentrationen der Verbindung am Anfang der Abbaureaktion (t = 0) und nach einer bestimmten Abbauzeit (t) an. Der Anreicherungsfaktor e stellt den proportionalen Zusammenhang zwischen der Änderung der Isotopensignatur und der Konzentration dar. Er ist spezifisch für i) jeden Schadstoff und ii) bestimmte Abbaubedingungen (z.B. aerob, sulfatreduzierend, eisenreduzierend etc.). Der prozentuale Schadstoffabbau (Biodegradation; B [%]) zwischen zwei Messstellen, die in einem kontaminierten Grundwasserleiter in einer Abstromlinie liegen, wird analog zu Gleichung 1 aus der Änderung des Isotopenverhältnisses und einem geeigneten Anreicherungsfaktor (e) bestimmt (Gl. 2). Die Berechnung liefert die durch den biologischen Abbau bewirkte Konzentrationsänderung Ct/C0 zwischen einer Messstelle mit hoher Schadstoffkonzentration (GWM0) und einer in ihrem Grundwasserabstrom befindlichen Messstelle mit niedriger Schadstoffkonzentration (GWMt). Der berechnete Abbau bezieht sich auf den Flächenbereich, der sich aufgrund der Ausbreitung in Folge von Verdünnungs-/Dispersionseffekten bis zur Messstelle GWMt ergibt. Bei der Abschätzung wird vereinfachend davon ausgegangen, dass entlang der betrachteten Grundwasserfließstrecke der Anreicherungsfaktor konstant sowie repräsentativ für die Biodegradation ist. Weiterhin wird ein eventueller Einfluss durch zusätzliche Schadstoffquellen mit unterschiedlichen Ausgangsisotopensignaturen vernachlässigt.
Die in Gl. 2 beschriebene zeitliche Änderung der Isotopensignatur (Isotopenanreicherung von d0 nach dt) lässt sich für zwei Messstellen in einer Schadstofffahne anwenden. Unter der Vorraussetzung einer direkten hydrogeologischen Verbindung zwischen einer hochkontaminierten Messstelle (meist die Schadstoffquelle) und einer in ihrem Grundwasserabstrom befindlichen Messstelle (x) mit dem Abstand s ergibt sich eine Isotopenanreicherung in der räumlichen Dimension (von d0 nach dx). Eine Umformung von Gl. 2 ermöglicht die Berechnung der räumlichen Abbaukonstante ls (Gl. 3). Dieser Parameter erster Ordnung (exponentieller Abbau) beschreibt die biologische Schadstoffreduzierung als Konzentrationsminderung pro Meter Fließstrecke [m-1].
Zur Bestimmung der zeitlichen Abbaukonstante lt [d-1] muss die Transportzeit auf der betrachteten Fließstrecke bekannt sein. Sie ergibt sich aus der GW-Fließgeschwindigkeit (v), dem Abstand zwischen den Messstellen (s) und evtl. dem substanzspezifischen Retardierungsfaktor r.
Analog zum räumlichen Abbau ist dann die Berechnung der zeitlichen in situ Abbaukonstante erster Ordnung lt [d-1] mit Hilfe der Veränderung des Isotopenverhältnisses und einem geeigneten Anreicherungsfaktor möglich (Gl. 4).
lt beschreibt die zeitliche Rate der Schadstoffreduzierung durch biologischen Abbau zwischen zwei Messstellen und ist somit ein wichtiges Werkzeug, um das Verhalten von Schadstoffe in einem kontaminierten Grundwasserleiter zu beschreiben. Für die Beurteilung der Abbaukinetik können die abgeschätzten Abbaukonstanten mit Daten aus Literaturstudien verglichen werden.
Die Abbaukonstanten können auch als biologische Halbwertszeit (t1/2) bzw. Halbwertstrecke (s1/2) dargestellt werden, welche die Zeit bzw. die Fließstrecke angeben, in der sich die Schadstoffkonzentration aufgrund des biologischen Abbaus halbiert (Gl. 5).
Das Produkt der Abbaukonstanten ls bzw. lt mit der Schadstoffkonzentration (Ct) in der abstromigen Messstelle liefert außerdem die absoluten Abbauraten ([μg L-1 m-1] bzw. [μg L-1 y-1] an der Messstelle. Diese verändern sich mit der Konzentration. Sie beschreiben den Konzentrationsrückgang ohne Berücksichtigung der Nachlieferung von Schadstoffen aus der Kontaminationsquelle. Die Abbauraten geben damit nicht den zu erwartenden Konzentrationsrückgang (pro Meter Fließstrecke oder pro Jahr) an der Messstelle an, da durch Zustrom aus der Schadstoffquelle die bestehende Konzentration weitgehend aufrecht erhalten wird.
Weiterhin lässt sich jene Fließstrecke ermitteln, die benötigt wird, bis durch den biologischen Abbau ein bestimmter Konzentrationsgrenzwert (Cx) unterschritten ist. Dieser sog. Reaktionsraum (R) berechnet sich mit Gl. (6):
Bestimmte Umweltbedingungen bewirken Unschärfen bei der Quantifizierung des Abbaus.
Einschränkungen im quantitativen in situ-Nachweis des biologischen Schadstoffabbaus mittels stabiler Isotopenfraktionierung (SIFA) ergeben sich neben messtechnischen Limitationen durch mehrere Faktoren. Grundsätzlich gilt jedoch, dass eine Isotopenfraktionierung >1‰ ein qualitativ hinreichender Nachweis für einen Schadstoffabbau ist. Für eine quantitative Bewertung müssen die genaueren Umstände der Schadstofffreisetzung und des Grundwassertransports bekannt sein.
Parallele physikalische Prozesse wie Sorption und Evaporation beeinflussen den Isotopengehalt einer Substanz zusätzlich zur biologischen Fraktionierung. Diese Veränderungen sind jedoch bei den genauer untersuchten Schadstoffgruppen (BTEX, PAK, PCE, MTBE) um 1-2 Größenordnungen geringer als biologische Effekte. Dennoch verursachen Huminstoffe (als Adsorptionsmatrix) oder eine geringe Wassersättigung (als Evaporationsraum) Unschärfen bei der quantitativen Abschätzung des biologischen Abbaus.
Parallele chemische Abbauprozesse können eine erhebliche Fraktionierung zur Folge haben (z.B. bei der chemischen Reduktion chlorierter Ethene durch Fe0, die bei reinigenden Grundwasserbarrieren angewendet wird). Insofern spiegelt eine signifikante Isotopenfraktionierung nicht zwingend einen biologischen Abbau wider, ihr Nachweis ist aber ebenso eine Erfolgskontrolle für chemischen Abbau.
Unterschiedliche Redoxbedingungen (d. i. die Verfügbarkeit von Elektronenakzeptoren wie O2, NO3, SO4, FeIII, HCO3) aktivieren in den abbauenden Mikroorganismen oft unterschiedliche Enzymsysteme. Unter oxischen Bedingungen werden z. B. häufig Dioxygenasen aktiviert, die zu einer geringen Isotopenfraktionierung von 13C führen, während unter anoxischen Bedingungen meist stark fraktionierende Monooxygenasen zum Schadstoffabbau dienen. In heterogenen und oxischen Bodenzonen, in denen die Redoxbedingungen wechseln, kann die Abbauleistung der Mikroorganismen daher relativ unabhängig von der Isotopenfraktionierung sein.
Die Abfolge oder die Mischung von verschiedenen Isotopenspezies desselben Schadstoffs erschwert die Interpretation einer Isotopenfraktionierung. Eine Maskierung der biologischen Prozesse ergibt sich z. B. wenn bei der Kontamination sukzessive verschiedene Isotopenspezies eines Schadstoffes freigesetzt wurden. Dies kann der Fall sein, wenn ein undichter Tank mit Toluol unterschiedlicher geographischer Herkunft (und daher mit unterschiedlichem Isotopengehalt) befüllt wurde.
Die Mischung von zwei Isotopenspezies eines Schadstoffes ergibt sich bei einer Mehrfachkontaminierung, wenn der Schadstoff sowohl Kontaminante als auch Abbauprodukt ist. Bei einer Vierfachkontaminierung mit chlorierten Ethenen (PCE-TCE-DCE-VC), die zugleich sukzessive dehalogeniert werden, sind deshalb für die letzteren drei Schadstoffe nur qualitative Aussagen zum biologischen Abbau möglich.